Introduction : Les métastases vésicales sont rares. Elles représentent moins de 2% des cancers de la vessie. Exceptionnellement, l’adénocarcinome gastrique peut donner des métastases vésicales. De rares cas de métastases vésicales ont été rapportés dans la littérature. Observation : Il s’agissait d’une patiente âgée de 58 ans, suivie depuis six ans pour adénocarcinome gastrique à cellules indépendantes, pour lequel elle fut opérée (Stade IIA). Elle présentait une rechute métastatique au niveau vésical de son adénocarcinome gastrique. Le diagnostic était confirmée par l’étude immunohistochimique. La patiente a été mise sous chimiothérapie palliative. Conclusion : Le diagnostic histologique de l’adénocarcinome à cellule indépendantes doit avant tout évoquer une origine primitive à distance. Les métastases vésicales d’un primitif gastrique restent exceptionnelles.
Introduction: Bladder metastases are rare. They represent less than 2% of bladder cancers. Exceptionally, gastric adenocarcinoma can lead to bladder metastases. Rare cases of bladder metastases have been reported in the literature. Case: A 58-year-old female patient had been followed for 6 years for gastric adenocarcinoma with independent cells (stage IIA). She had a metastatic relapse of her gastric adenocarcinoma in the bladder. The diagnosis was confirmed by the immunohistochemical study. The patient received a palliative chemotherapy. Conclusion: The histological diagnosis of vesical cell adenocarcinoma may be secondary and a primitive location should be retrieved. Bladder metastases of a gastric primitive remain exceptional.
Le cancer de la vessie est le 2ème cancer de l’appareil urogénital chez l’homme largement dominé par le carcinome urothélial qui représente 90% de tous les cancers de la vessie. Cependant, l’adénocarcinome primitif ne représente pas plus de 2% des tumeurs infiltrantes du muscle vésical faisant évoquer en premier l’origine secondaire de cette localisation dont le primitif gastrique reste exceptionnel et représente 4,3 % de l’ensemble des primitifs donnant des métastases vésicales [1].
Il s’agissait d’une patiente âgée de 58 ans, sans antécédant familial de néoplasie ni notion d’infection urinaire à répétition, suivie dans le département d’oncologie médicale pour un adénocarcinome gastrique à cellules indépendantes pour lequel une gastrectomie totale avec curage ganglionnaire D1,5 et anastomose oeso-jéjunale ont été réalisés.

La tumeur a été classée p T3N0M0 R0 soit un stade IIA selon la classification AJCC de 2010. Aucun traitement adjuvant n’a été reçu.
Après 6 ans de bon contrôle clinique biologique et radiologique, la patiente a présenté une hématurie macroscopique associée à une dysurie et une pollakiurie.

L’échographie vésicale a montré un épaississement hyperéchogène occupant la moitié de la vessie avec un bourgeon endovésical.
La cystoscopie a objectivé une muqueuse vésicale inflammatoire et hémorragique avec une lésion suspecte occupant plus de la moitié de la muqueuse vésicale.
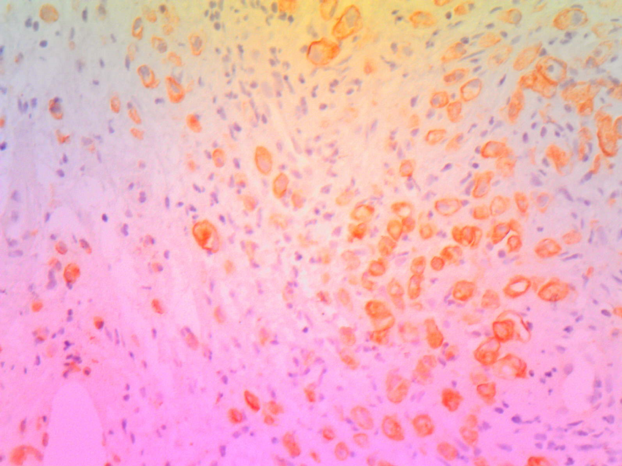
L’étude anatomopathologique de la biopsie vésicale a montré une infiltration vésicale par un processus tumoral carcinomateux indifférencié à cellules indépendantes (Figures 1, 2).
L’immunohistochimie était en faveur de l’origine gastrique de cette prolifération tumorale avec le marquage positif des cytokératines anti AE1/AE3 et anti CK7 et un marquage négatif des anticorps anti CK20 et anti CDX2 (Figure 3).
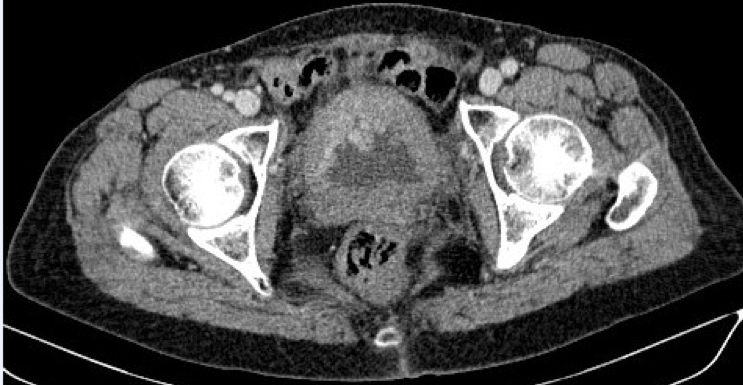
Le bilan d’extension (une tomodensitométrie thoraco-abdominopelvienne) n’a pas révélé d’autres localisations à distance tandis que les marqueurs tumoraux (ACE , CA19,9 ) ont été élevés évoquant une origine digestive (Figure 4).
Un pet scanner a été indiqué mais il n’a pas été réalisé pour des raisons financières.
Devant le refus de la chirurgie par la patiente, une chimiothérapie à base d’une association de Capécitabine et d’oxaliplatine a été indiquée. La patiente a reçu jusqu’à présent deux cures avec une bonne tolérance clinique et biologique.
Le cancer gastrique constitue le deuxième cancer chez l'homme et le 3ème cancer chez la femme en Asie et à travers le monde. En se basant sur les données du GLOBOCAN 2008, le cancer gastrique est le second cancer digestif après les cancers colorectaux et la quatrième cause de décès par cancer [1, 2].
Ainsi l’adénocarcinome gastrique est responsable de métastases pulmonaire, hépatique, péritoine, osseuse et plus rarement ovarienne (Krukenberg). Les différents mécanismes pouvant contribuer au développement des métastases vésicales à partir d’un adénocarcinome gastrique sont l’extension directe par l’implantation des cellules tumorales décollées au niveau des uretères, la diffusion lymphatique, hématogène ou péritonéale [3].
| Critères | Adénocarcinome à cellules indépendantes primitif | Métastase d’un Adénocarcinome à cellules indépendantes primitif gastrique |
|---|---|---|
| Antécédant néoplasique digestif. | Souvent absent | Souvent présent |
| Prévalence | 0.24% des cancers primitifs vésicaux | 4,3% des cancers gastriques métastatiques |
| Hématurie | +++ | +++ |
| Imagerie radiologique | Épaississement diffus le plus souvent. | Lésion unique le plus souvent. |
| Cystoscopie | Lésions multiples ou diffuses le plus souvent | Lésion unique le plus souvent |
| Critères anatomopathologiques | Histologie identique avec +/- un contingent de carcinome épidermoïde ou de carcinome urothéliale adjacent. Critères MOSTOFI : des formations polypoïdes, des nids de Brunn, une métaplasie glandulaire, des cellules transitionnelles | Histologie identique avec une muqueuse adjacente saine Critères de Csilla András : anti CK7, anti EMA, anti ACE, et anti CA19-9 positifs, anti CK20 négatifs |
La localisation primaire d’un adénocarcinome en bague à chaton au niveau vésical est exceptionnelle. Elle représente approximativement 4,3 % de l’ensemble des cancers gastriques métastatiques [4].
Il est difficile de différencier entre une tumeur vésicale primitive et secondaire sur la base des données cliniques ou radiologiques (Tableau 1).
Chez notre patiente l’hématurie macroscopique était le premier signe d’appel. La découverte d’un adénocarcinome à cellules indépendantes de localisation vésicale rend peu probable le diagnostic de cancer primitif vésical, vue sa prévalence très faible estimée à 0,24% de l’ensemble des tumeurs malignes primaires de la vessie. Quelques indices peuvent aider à faire la part des choses, en premier l’histoire clinique qui oriente en général le diagnostic, cela était le cas chez notre patiente avec l’histoire de cancer gastrique opéré. L’exploration de cette hématurie impose la réalisation d’une cystoscopie qui est l'outil de diagnostic le plus sensible et le plus spécifique [5].
L’aspect cystoscopique peut également être utile, en effet, contrairement au cancer primitif vésical les tumeurs secondaires sont presque toujours solitaires et sont souvent (54% des cas) situées au niveau de la région du dôme [6].
La tomodensitométrie et l'imagerie par résonance magnétique sont également des techniques utiles pour diagnostiquer les cancers de la vessie. Les lésions métastatiques se présentent généralement comme des lésions solitaires avec un épaississement focal de la paroi de la vessie cet épaississement peu être diffus dans certains cas [7].
Sur le plan histologique, les adénocarcinomes vésicaux à cellules en bague à chaton sont indiscernables de leurs homologues des autres organes. Certes la présence d’une composante carcinomateuse urothéliale ou épidermoïde adjacente pourrait confirmer le diagnostic d’un cancer primitif vésical alors qu’un urothélium adjacent sans anomalie évoque plus une localisation secondaire. Mostofi et al proposent qu’on peut évoquer l’origine vésicale de l’adénocarcinome si la muqueuse contient des formations polypoïdes, des nids de Brunn, une métaplasie glandulaire ou s’il y a des cellules transitionnelles associées. Csilla András et al. ont retenu le diagnostic de métastase vésicale d’un adénocarcinome primitif gastrique devant des anticorps anti CK7, anti EMA, anti ACE, et anti CA19-9 positifs ; et des anticorps anti CK20 négatifs. Même si de nombreux marqueurs immunohistochimiques étaient proposés pour faire la distinction entre les adénocarcinomes primaires et secondaires de la vessie, leur intérêt dans les adénocarcinomes à cellules indépendantes reste peu clair et peu étudié [8-10].
L’adénocarcinome en bague à chaton gastrique est une entité clinico-histopathologique particulière du cancer de l’estomac, redouté par sa chimio-résistance et son mauvais pronostic.
La prise en charge de la métastase unique au niveau de la vessie est essentiellement curative et repose essentiellement sur la chirurgie. Une stratégie palliative basée sur l’association des drogues de chimiothérapie actives dans le cancer gastrique soit l’Epirubicine, le cisplatine ou oxaliplatine et le 5 Fluoro-Uracile (5FU) est indiquée +/- Herceptin en cas de surexpression de Her2 [11].
Dans notre cas, la chirurgie a été refusée par la patiente.
Malgré cette stratégie de prise en charge le pronostic est sombre vu l’agressivité de la localisation de la métastase au niveau de la vessie et les survies limitées du cancer gastrique métastatique.
La vessie est un site métastatique rare. Une localisation secondaire d’un primitif gastrique à son niveau reste exceptionnelle. Le diagnostic histologique de l’adénocarcinome vésical doit avant tout évoquer une origine primitive à distance, afin de bien définir la stratégie thérapeutique qui est totalement différente.
- Benâaboud I, Ghazli M, Kerroumi M, Mansouri A. [Krukenberg tumor: 9 cases report]. J Gynecol Obstet Biol Reprod (Paris). 2002;31:365-70 pubmed
- Velcheti V, Govindan R. Metastatic cancer involving bladder: a review. Can J Urol. 2007;14:3443-8 pubmed
- Leddy F, Peterson N, Ning T. Urogenital linitis plastica metastatic from stomach. Urology. 1992;39:464-7 pubmed
- Farhat M, Moumneh G, Jalloul R, El Hout Y. Secondary adenocarcinoma of the urinary bladder from a primary gastric cancer. J Med Liban. 2007;55:162-4 pubmed
- Mostofi F, THOMSON R, Dean A. Mucous adenocarcinoma of the urinary bladder. Cancer. 1955;8:741-58 pubmed