Introduction : La myélite lupique reste une complication rare et peu connue de la maladie lupique qui se caractérise par sa gravité et son très mauvais pronostic. Observation : Patiente âgée de 32 sans antécédents pathologiques notables, fut hospitalisée pour exploration d’une impotence motrice brutale des deux membres inférieurs survenant dans un contexte fébrile. L’examen clinique et les explorations biologiques et radiologiques ont permis de retenir le diagnostic d’un lupus érythémateux systémique avec atteinte hématologique, rénale et neurologique à type de myélite transverse de type longitudinale. La recherche d’anticorps anti phospholipides était négative. Les anticorps anti cytoplasme des polynucléaires neutrophiles de type périphérique (p-ANCA) étaient positifs en immunofluorescence et de spécificité anti myélopéroxydase (anti-MPO) à l’ELISA. Conclusion : Notre observation se distingue par sa topographie longitudinale, son caractère inaugurale de la maladie et son association à la présence des auto-anticorps de type p-ANCA laissant supposer une micro angéite médullaire ANCA-dépendante à son origine.
Introduction: Lupus myelitis is a rare and little known complication of lupus disease characterized by gravity and very poor prognosis. Observation: a 32-year-old patient without any significant medical history, was hospitalized for exploration of a sudden motor weakness of both lower limbs occurring in a fever. Clinical, biological and radiological investigations allowed to retain the diagnosis of systemic lupus erythematosus with hematologic, renal, and neurological-type transverse myelitis longitudinal type. The search for anti phospholipid antibodies was negative. Anti cytoplasm of peripheral-type neutrophils antibodies (p-ANCA) were positive by immunofluorescence and anti myeloperoxidase specificity (MPO) in ELISA. Conclusion: Our case is distinguished by its longitudinal topography, inaugural nature of the disease and association with the presence of p-ANCA type of autoantibody, suggesting a micro spinal vasculitis ANCA-dependent to its origin.
La myélite transverse (MT) est une affection inflammatoire focale rare de la moelle épinière, dont les étiologies sont multiples et variées incluant les causes infectieuses, toxiques, compressives et les maladies de système [1-3]. Elle peut être aiguë ou subaiguë ; les formes aiguës sont les plus graves avec un plus mauvais pronostic [1].
Le lupus érythémateux systémique (LES) est une étiologie exceptionnelle de MT aiguë : 1 seul cas sur 70 observations de MT mondialement recensées entre 2000 et 2008, soit 1.42% [3] et bien que la fréquence de la MT au cours du LES se trouve multipliée par 1000 par rapport à la population générale [4], cette manifestation reste très rare puisqu’elle complique seulement 1 à 2% des cas de LES [5]. Elle est exceptionnellement révélatrice de la maladie.
La forme longitudinale de cette myélopathie est rarement rapportée. Elle se caractérise par sa clinique manifeste, sa gravité et son mauvais pronostic. Nous rapportons une observation de myélite longitudinale inaugurale d’un lupus.
Patiente âgée de 32 sans antécédents pathologiques notables, fut hospitalisée via les urgences pour exploration d’une impotence motrice brutale des deux membres inférieurs survenant dans un contexte fébrile.
L’interrogatoire notait que les plaintes remontaient à cinq jours avant son admission avec l’apparition brutale de céphalées holocraniennes associées à une fièvre non chiffrée suite à une exposition solaire prolongée; deux jours plus tard, la patiente sentait une lourdeur des deux membres inférieurs avec incontinence sphinctérienne fécale et urinaire incitant son hospitalisation en urgence pour exploration.

L’examen initial notait une fièvre à 38,6°C, une érythrose des pommettes, une tachycardie régulière à 110 bt/mn avec une auscultation cardio-pulmonaire normale, une conscience conservée, une paraplégie flasque avec un déficit sensitivomoteur total des deux membres inférieurs, une aréflexie ostéo-tendineuse à leur niveau, des réflexes cutanés plantaires indifférents des deux côtés et un niveau sensitif D5-D6, un œdème blanc mou et gardant le godet des membres inférieurs et des flancs et des escarres débutantes aux deux talons. Par ailleurs, on notait un globe vésical et la mise en place de la sonde urinaire ramenait 1,600 l d’urines concentrées. Le reste de l’examen somatique était sans anomalies.
A la biologie on notait une anémie normochrome normocytaire régénérative à 9,7g/dl, une thrombopénie à 85.000/mm3; une leucopénie à 3.50/mm3, une neutropénie à 1.200/mm3, un syndrome inflammatoire biologique avec une vitesse de sédimentation érythrocytaire à 116 mm/h et une protéine C réactive à 76 mg/l, une insuffisance rénale avec créatinine sanguine à 465 μmol/l et une leucocyturie aseptique à 110 élément/mm3. Les tests hépatiques, le bilan d’hémostase et la glycémie étaient normaux.
Ponction lombaire ramenait un liquide clair normotendu avec à l’analyse une méningite lymphocytaire : leucocytes à 60 éléments/mm3 dont 75% des lymphocytes; hématies à 2 éléments/mm3, hyperalbuminorrachie 0,6 g/l et hypoglucorrachie 1,05 mmol/l (glycémie sanguine étant à 4.8 mmol/l). L’examen direct et la culture du liquide céphalorachidien étaient négatifs de même que la recherche des antigènes solubles.
Le bilan infectieux était négatif : hémocultures, examen cytobactériologique des urines, la radiographie de thorax, l’échographie cardiaque, les sérologies virales et bactériennes.
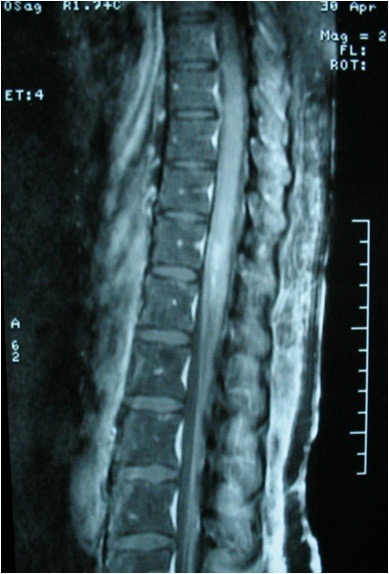
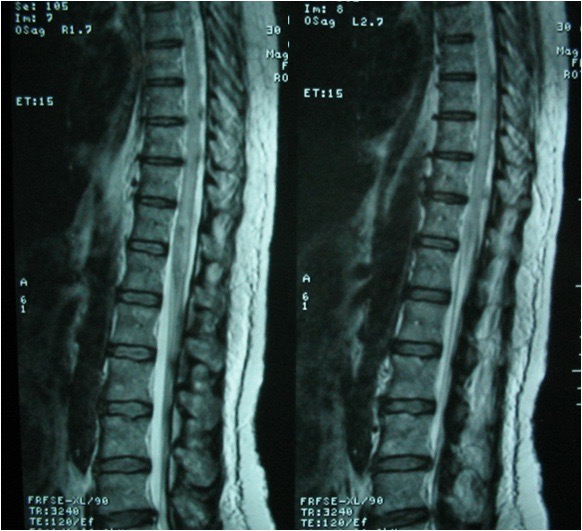
Une imagerie par résonance magnétique médullaire pratiquée confirmant la myélite de type transverse étendue avec un hypersignal en pondération T2 et FLAIR (figures 1 et 2) et prise de contraste après injection de gadolinium en pondération T1 (figure 3) de la moelle épinière lombaire et dorsale.
Le diagnostic de lupus fortement suspecté devant l’association (thrombopénie, leucopénie, anémie d’allure hémolytique, insuffisance rénale, leucoyturie aseptique, méningite lymphocytaire) était confirmé par la suite des explorations : test de Coombs direct positif de type IgG-complément, syndrome néphrotique avec à l’histologie rénale une glomérulonéphrite proliférative diffuse (néphropathie lupique classe IV), des anticorps antinucléaires (AAN) positifs de fluorescence mouchetée et des anti-DNA natifs et anti Sm positifs. La recherche d’anticorps anti phospholipides était négative (anti-cardiolipine et anti-β2-glycoprotéine1). Les anticorps anti cytoplasme des polynucléaires neutrophiles de type périphérique (p-ANCA) étaient positifs en immunofluorescence. Cette positivité était confirmée par le test ELISA avec une spécificité anti myélopéroxydase (anti-MPO).
Elle a été traitée par trois boli de méthylprednisolone (1g/j) relayés par une corticothérapie systémique à la dose de 1mg/kg/j pendant un mois suivie d’une décroissance progressive et des boli mensuels de cyclophosphamide.
L’évolution était marquée par l’apyrexie au troisième jour, la disparition de l’hyperleucocytose, de la protéine C réactive et normalisation de la fonction rénale au bout d’une semaine.
Sur le plan neurologique aucune récupération n’a été constatée au bout de quatre mois de suivi malgré le traitement et la rééducation motrice précocement entamée. La patiente était perdue de vue après son cinquième bolus de cyclophosphamide.
La MT représente, à côté du syndrome de démyélinisation, les tableaux neurologiques les moins prévalents et les plus graves parmi les douze tableaux cliniques classiques du neuro-lupus récemment définis par le Collège Américain de Rhumatologie (ACR) [6]. La grande revue systématique de la littérature faite par Li XY. et al., en 2014 retrouvait seulement 93 cas de myélite lupique rapportés sur une période de plus de 50 ans (1960-2013) [7].
La myélite lupique survient chez les deux sexes et à tout âge, même chez l’enfant [5, 8]. Elle se voit classiquement au cours de l’évolution du LES, mais peut exceptionnellement être la première manifestation révélatrice de la maladie [5, 9, 10].
Sur le plan clinique, la MT doit être suspectée devant tout déficit neurologique des membres; en particulier une para ou tétraparésie/para ou tétraplégie associée à un déficit sensitif et un dysfonctionnement sphinctérien [11]. Ce tableau clinique n’est pas toujours stéréotypé et peut se résumer à des symptômes inhabituels tel que des vomissements isolés et incohercibles [12] ou à l’opposé avoir une présentation dite « catastrophique » avec une para ou tétraplégie et des incontinences urinaire et fécale [13]. Ces formes catastrophiques sont rares : la revue de la littérature faite par Espinosa G. et al. entre 1966 et 2008 n’en retrouvait que 22 cas [14].
| Type de la myélite Caractéristiques | Myélite de la substance grise | Myélite de la substance blanche |
|---|---|---|
| Symptômes prodromiques | Fièvre, rétention urinaire | - |
| Manifestations neurologiques | Flaccidité, hyporéflexie | Spasticité hyperréflexie |
| Evolution | Monophasique | Polyphasique |
| Activité de la maladie lupique | SLEDAI =9.8 (active) | SLEDAI = 2 (inactive/peu active) |
| Liquide céphalo-rachidien | Aspect puriforme (≈ méningite bactérienne) | - |
| Auto-anticorps | - | - Anti-phospholipides - Anti NMO-IgG |
Par ailleurs, la myélite lupique peut exceptionnellement avoir une présentation clinique particulière de neuromyélite optique ou maladie de Devic associant par définition une MT étendue sur au moins trois segments médullaires contigus, une névrite optique et des anticorps anti NMO-IgG (anti Neuromyelitis Optica de type IgG), ou anti aquaporine-4-IgG positifs [12, 15-18], représentant un vrai challenge diagnostique et thérapeutique pour le clinicien [18].
Sur le plan topographique, le processus inflammatoire médullaire au cours du LES est souvent focal et étendu à plusieurs segments médullaires mais peut plus rarement toucher la totalité de la moelle [5] et même se compliquer d’une encéphalite disséminée [19]. L’atteinte de plus de quatre segments médullaires contigus définit la myélite lupique dite « longitudinale », forme la plus grave de myélopathie lupique [10, 11, 13, 20]. Cette forme est rarement rapportée : seulement une dizaine de cas retrouvés dans la littérature [21].
La mise à jour de septembre 2013 de la fameuse « Hopkins Lupus Cohort » avait révélé deux importantes découvertes concernant la myélite lupique [22].
- La présentation clinico-anatomique est souvent celle d’une myélite longitudinale plutôt qu’une MT classique.
- La myélite lupique présente deux formes cliniques distinctes :
- La myélite de la substance blanche.
- La myélite de la substance grise : plus grave, plus résistante au traitement et souvent compliquée de séquelles irréversibles.
- Les caractéristiques respectives de ces deux formes sont résumées dans le tableau I.
Une association avec la présence des anticorps anti phospholipides est souvent signalée chez les lupiques avec MT, incriminant ces auto-anticorps thrombogènes dans la pathogénie de cette complication [23]. Cette constatation reste controversée [6] puisque des cas de MT ont été observés chez des lupiques sans auto-anticorps anti phospholipides [5, 24] et de ce fait l’anticoagulation systématique pour ces myélites n’a pas démontré un effet bénéfique particulier dans les séries comparatives. [23].
Chez notre patiente se sont plutôt les auto-anticorps anti-cytoplasme des polynucléaires neutrophiles de type périphérique (p-ANCA) à spécificité anti-myéloperoxydase (anti-MPO) qui semblent être incriminés dans la genèse de cette myélite lupique. En effet, il est connu que la présence des ANCA au cours du LES est loin d’être rare (3-69%) [25] mais le plus souvent il s’agit d’ANCA dits « atypiques » (non p-ANCA, non c-ANCA) ou faussement positifs (immunofluorescence positive alors que la recherche par ELISA reste négative) du fait de la forte positivité diffuse des auto-anticorps anti-nucléaires [26].
La présence d’ANCA se trouve corrélée à la sévérité de la maladie lupique et ces auto-anticorps semblent être incriminés dans la genèse des atteintes rénales, neurologiques, séreuses et myocardiques de la maladie [27].
Nous évoquons une vascularite médullaire favorisée par les p-ANCA à l’origine de la myélite chez notre patiente. Cette hypothèse se trouve renforcée par l’étude autopsique du cas de MT lupique de Tono T. et al. ayant objectivé une vascularite diffuse de la moelle épinière [19].
Le traitement de la myélite lupique repose sur la combinaison corticoïdes-immunosuppresseurs, en particulier le cyclophosphamide [11, 28, 29]. Cette conduite thérapeutique est validée par les recommandations de l’EULAR (The European League Against Rheumatism : la ligue européenne contre le rhumatisme) pour la prise en charge des manifestations neuropsychiatriques du LES [29]. Le mycophénolate mofétil, en association avec les glucocorticoïdes, peut être prescrit en seconde ligne si résistance ou non amélioration sous cyclophosphamide [30].
Les anticorps monoclonaux anti-CD20 peuvent être efficacement utilisés dans les formes réfractaires de myélite lupique [31, 32].
La myélite lupique reste une complication rare et peu connue de la maladie lupique qui se caractérise par sa gravité et son très mauvais pronostic. Un diagnostic précoce ainsi qu’une prise en charge intensive et adaptée sont préconisées pour améliorer l’issue de cette affection.
Notre observation se distingue par sa topographie longitudinale, son caractère inaugurale de la maladie et son association à la présence des auto-anticorps de type p-ANCA laissant supposer une micro angéite médullaire ANCA-dépendante à son origine.
SLEDAI : Systemic Lupus Erythematosus Disease Activity Index (indice d’activité de la maladie lupique), Anti-MNO-IgG : anti Neuro-Myelitis Optica-IgG (anticorps anti Neuro-Myélité Optique de type IgG).
- Linssen W, Fiselier T, Gabreels F, Wevers R, Cuppen M, Rotteveel J. Acute transverse myelopathy as the initial manifestation of probable systemic lupus erythematosus in a child. Neuropediatrics. 1988;19:212-5 pubmed
- Huang L, Chung C, Chen B, Chi N, Hu C. Systemic lupus erythematosus presented as extensive longitudinal myelitis. Acta Neurol Taiwan. 2013;22:67-71 pubmed
- Espinosa G, Mendizábal A, Minguez S, Ramo-Tello C, Capellades J, Olive A, et al. Transverse myelitis affecting more than 4 spinal segments associated with systemic lupus erythematosus: clinical, immunological, and radiological characteristics of 22 patients. Semin Arthritis Rheum. 2010;39:246-56 pubmed publisher
- Jiang D, Liao Y, Bai Y. Successful treatment for neuromyelitis optica with systemic lupus erythematosus. Chin Med J (Engl). 2013;126:3996 pubmed
- Tono T, Nagai T, Hoshiyama T, Sakuma Y, Wada T, Tanaka S, et al. Transverse myelitis extended to disseminated encephalitis in systemic lupus erythematosus: Histological evidence for vasculitis. Mod Rheumatol. 2014;:1-5 pubmed
- Campana A, Buonuomo P, Insalaco A, Bracaglia C, Capua M, Cortis E, et al. Longitudinal myelitis in systemic lupus erythematosus: a paediatric case. Rheumatol Int. 2012;32:2587-8 pubmed
- Gude D, Chennamsetty S, Bansal D, Jha R. Transverse myelitis in antiphospholipid antibody negative systemic lupus erythematosus. J Indian Med Assoc. 2013;111:406-7 pubmed
- Molnar K, Kovacs L, Kiss M, Husz S, Dobozy A, Pokorny G. Antineutrophil cytoplasmic antibodies in patients with systemic lupus erythematosus. Clin Exp Dermatol. 2002;27:59-61 pubmed
- Cavagna L, Caporali R, Esposito C, Augetti C, Epis O, Montecucco C. Clinical features of ANCA-positive systemic lupus erythematosus: report of two cases. Scand J Rheumatol. 2007;36:74-6 pubmed
- Bertsias G, Ioannidis J, Aringer M, Bollen E, Bombardieri S, Bruce I, et al. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations: report of a task force of the EULAR standing committee for clinical affairs. Ann Rheum Dis. 2010;69:2074-82 pubmed publisher
- Tomietto P, Annese V, De Vita S, Ferraccioli G. Mycophenolate mofetil and intravenous dexamethasone in the treatment of persistent lupus myelitis. J Rheumatol. 2007;34:588-91 pubmed
- Chehab G, Sander O, Fischer-Betz R, Schneider M. [Anti-CD20 therapy for inducing and maintaining remission in refractory systemic lupus erythematosus]. Z Rheumatol. 2007;66:328, 330-6 pubmed
- Armstrong D, McCarron M, Wright G. SLE-associated transverse myelitis successfully treated with Rituximab (anti-CD20 monoclonal antibody). Rheumatol Int. 2006;26:771-2 pubmed
