La cancérisation est une complication rare des kystes dermoïdes ovariens survenant dans 1 à 3% des cas. Elle se voit le plus souvent en période péri ménopausique. Plusieurs arguments permettent de suspecter la transformation maligne en préopératoire, mais le diagnostic de certitude repose sur l’étude anatomopathologique de la pièce opératoire. Nous rapportons un cas de tumeur maligne de l’ovaire à double contingent (carcinome épidermoïde et tumeur de la granulosa) développée sur un kyste dermoïde de l’ovaire chez une patiente âgée de 24 ans a bénéficiée d’une hystérectomie totale sans conservation annexielle, sans aucun traitement donné en adjuvant, une surveillance a été indiquer chez elle, actuellement la patiente est avec recule de 3 ans. A notre connaissance, cette association est rare dans la littérature.
Malignant transformation is an uncommon complication in 1 to 3% cases of mature cystic teratoma. It is usually observed in elderly women. Many elements may indicate the malignant transformation but the diagnosis is based on anatomo-pathological analysis. We present an unusual case of malignant tumor with double contingent (squamous cell carcinoma and granulosa cell tumor) arising from a mature cystic teratoma on a young woman 24 years old. She underwent a surgery by removing the uterus and annexes and has been under surveillance for three years. To the best of our knowledge, this association is rare in literature.
Le tératome kystique de l’ovaire ou kyste dermoïde est une tumeur germinale non séminomateuse bénigne qui représente environ 10 à 20% des tumeurs ovariennes [1]. Il se voit surtout chez la femme jeune en période d’activité génitale. Sa dégénérescence est une éventualité rare survenant dans 1 à3% des cas [2]. Elle est habituellement observée chez la femme ménopausée avec une moyenne d’âge de 52 ans [3].Le type histologique généralement retrouvé est le carcinome épidermoïde.
Nous rapportons un cas de tumeur maligne de l’ovaire à double contingent (carcinome épidermoïde et tumeur de la granulosa) développée sur un kyste dermoïde de l’ovaire chez une jeune patiente de 24 ans. Cette association est rare, à notre connaissance, dans la littérature.
Nous rapportons le cas d’une patiente âgée de 24ans, nullipare nulligeste. Les manifestations cliniques ont débuté 3 mois avant le diagnostic par des douleurs abdominales diffuses avec distension abdominale sans troubles du transit ni troubles urinaires ni altération de l’état général.

L’examen clinique retrouvait une masse pelvienne de 5 cm de grand axe rénitente, indolore et mobile. Le toucher vaginal avait mis en évidence une masse latéro-utérine gauche sans saignement génital. Scanner abdomino-pelvienne a montré une formation kystique latéro- utérine gauche 47/40 mm à paroi discrètement épaissie mais régulière mais ne prenant pas le contraste sans adénopathie profonde et respectant la graisse pelvienne volumineux kyste de 20 cm développé aux dépens de l’ovaire gauche contenant un liquide épais et s. L’aspect était à priori évocateur d’un kyste dermoïde.
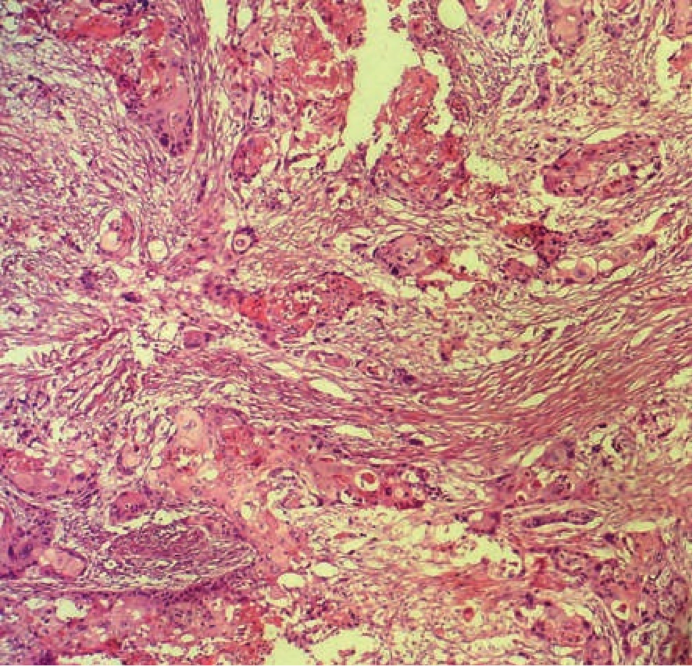
Après libération des adhérences, une annexectomie droite est réalisée, macroscopiquement, la formation kystique pluri-loculaire rempli de liquide trouble ou d’un matériel sébacé de cheveux et en bordure Soulève par un pied mesurant 3.5/3.5/1 cm. A l’étude microscopique, la paroi kystique était bordée d’un revêtement malpighien siège de désorganisation architecturale. Les cellules tumorales, sièges d’atypies cytonucléaires et de mitoses anormales, étaient disposées en boyaux anastomosés et en nappes. L’examen histologique concluait à un carcinome épidermoïde moyennement différentié et infiltrant sur kyste dermoïde de l’ovaire droit (fig. 2) avec tumeur de la granulosa de l’adulte.
Une hystérectomie totale sans conservation annexielle ainsi qu’une omentectomie ont été réalisées ultérieurement. Les suites postopératoires immédiates étaient simples.
La transformation maligne est une complication rare des kystes dermoïdes survenant le plus rarement en période péri ménopausique et exceptionnelle avant l’âge de 30 ans. Elle peut porter sur les dérivés d’un ou plusieurs feuillets embryonnaires (endodermique, ectodermique et mésodermique) avec prédominance des éléments d’origine ectodermique en général [4]. Le carcinome épidermoïde est observé dans près de 80% des cas. Ailleurs, il peut s’agir d’un carcinome baso-cellulaire, d’un mélanome malin, d’un sarcome, d’un carcinome thyroïdien papillaire, d’une tumeur carcinoïde ou de tumeur neuro-ectodermale [3]. Des cas isolées d’adénocarcinomes prostatiques ou gastro-intestinaux, de glioblastome ou de carcinome à petites cellules ont été décrits [4].Afin d’identifier parmi les kystes dermoïdes ceux qui ont le plus de potentiel dégénératif, Noumoff et al. ont comparé le caryotype du contingent bénin et du contingent malin sur un tératome de l’ovaire cancérisé chez une femme de 36 ans. L’étude du contingent bénin a retrouvé une diploïdie dans toutes les cellules étudiées ainsi que des délétions des chromosomes 4, 6 et 7 et des duplications du chromosome20. L’étude du contingent malin a montré, en plus des anomalies retrouvées dans le tissu bénin, de multiple copies des chromosomes 8, 11, ainsi que des t (8;14) et t (11;14). Une polyploïdie a aussi été retrouvée alors qu’elle n’a été vue dans aucune de cellules bénignes [5]. Les manifestations cliniques sont superposables à celles des tumeurs ovariennes bénignes. Elles sont dominées par la distension abdominale, les algies pelviennes surtout à type de pesanteur, la dyspareunie et les signes de compression digestifs et urinaires. Il est de ce fait difficile d’évoquer la dégénérescence du kyste dermoïde à l’étape clinique.
L’échographie est un examen fiable pour le diagnostic positif des kystes dermoïdes. La présence d’éléments organoïdes tels que les poils, os et dents constitue le principal critère de détection. Par contre, le diagnostic de dégénérescence est difficile à évoquer d’autant plus que la présence d’adhérences aux organes de voisinage peut être observée dans les kystes dermoïdes rompus.
La présence d’un flux sanguin intra tumoral ainsi que d’un index de pulsabilité et de résistance moyennement abaissés à l’écho-doppler ne semble pas être d’apport majeur pour détecter leur transformation maligne [6].
La TDM reste le meilleur examen dans la détection des kystes dermoïdes. Le diagnostic est fondé sur la détection d’une densité graisseuse dans 88% des cas et sur l’identification d’une protubérance de Rokitanski dans 91% des cas (formation arrondie appendue à la paroi du kyste dermoïde, à bords internes nets, contenant des dents, du tissu adipeux et un tissu conjonctif prenant tardivement le contraste).
La performance de l’IRM avec séquence de suppression de graisse est voisine de celle de la TDM. En faveur de la malignité, on recherchera des bords irréguliers nettement rehaussés après injection de produit de contraste, et la présence d’éléments solides à l’intérieur même d’un contenu essentiellement liquidien [7] [8]. Plusieurs auteurs ont tenté de regrouper les arguments qui permettent de suspecter la dégénérescence des kystes dermoïdes en préopératoire. Le taux de SCC (squamous cellcarcinoma) paraît être le critère le plus fiable. Lors de la découverte d’un kyste dermoïde et quel que soit le volume tumoral, tout dépassement de la valeur seuil du taux de SCC sérique (≥ 2 ng/ml) doit faire rechercher d’autres éléments en faveur de la malignité afin d’adapter la conduite chirurgicale [9].
Néanmoins, dans le cas de petites tumeurs, ou aux stades précoces, un taux inférieur à 2 ng/ml n’élimine pas le diagnostic de transformation maligne [10]. Le SCC peut être élevé dans certains kystes dermoïdes bénins, d’où l’intérêt de l’évaluer en même temps que d’autres facteurs de risque.
Mori et al. [11] ont démontré qu’un âge > 40 ans et un taux de SCC > 2,5 ng/ml ont une sensibilité de 77% et une spécificité de 96% dans la détection de la transformation maligne.
Suzuki a montré qu’il existe une corrélation entre le taux de SCC et la taille tumorale puisque le taux de SCC s’est avéré supérieur à la valeur seuil chez les patients ayant un volume tumoral supérieur à 500 cm3 [12].
Tseng, quant à lui, a noté une corrélation du taux de SCC avec le stade ainsi qu’une ré- ascension en cas de récidive [13].L’âge de la patiente est aussi un élément important. Toute découverte de kyste dermoïde ovarien en période ménopausique doit faire suspecter la dégénérescence maligne. Le pic d’incidence de cancérisation étant maximal entre 45 et 60 ans [3].
Toutes les séries publiées tendent à démontrer que la transformation maligne survenait exceptionnellement sur des kystes dermoïdes de taille inférieure à 6 cm. Certains auteur sont même corrélé une taille supérieure ou égale à 99 mm dans son plus grand axe, à un haut risque de transformation maligne [14].
La vitesse de croissance du kyste dermoïde est aussi à prendre en considération. Toute augmentation de taille en période ménopausique ou toute croissance supérieure à 2 cm par an en période d’activité génitale doit accroître la vigilance du clinicien.
Aucun de ces critères n’est formel et le diagnostic de certitude repose sur l’étude anatomopathologique de la pièce opératoire. L’intérêt majeur de reconnaître le caractère malin du kyste dermoïde en préopératoire est de privilégier la laparotomie au lieu de l’abord coelioscopique qui est d‘usage courant dans le kyste dermoïde et ce afin d’éviter la rupture intra-péritonéale qui aggrave le pronostic.
Aucune étude prospective n’a permis la mise en place d’une stratégie thérapeutique codifiée vu la rareté de l’affection. Néanmoins, l’exérèse chirurgicale radicale comprenant une hystérectomie totale sans conservation annexielle et une omentectomie est la première étape du traitement. Dans le cas du stade IA survenant chez une femme jeune, on peut se contenter d’une annexectomie unilatérale sans traitement adjuvant [3]. Tseng et al. ont obtenu 100% de survie à 2 ans pour les stades IA en adoptant cette approche [13]. Le curage ganglionnaire reste controversé puisque l’extension se fait surtout de proche en proche et par voie péritonéale [15].
La place de la radiothérapie et de la chimiothérapie n’est pas encore déterminée. Les protocoles de chimiothérapie usuellement administrés dans les tumeurs germinales tels quelle BEP (bléomycine, etoposide, cisplatine) se sont montrés décevants dans les carcinomes épidermoïdes sur kystes dermoïdes de l’ovaire [16].
Certains auteurs ont utilisé la mono, poly-chimiothérapie à base de cisplatine, la radiothérapie ou la combinaison de ces deux modalités et ont obtenu des résultats variables : Kurtz et al. ont traité une patiente de 34 ans ayant un carcinome épidermoïde de l’ovaire développé sur kyste dermoïde classé III (extension au sigmoïde et métastases péritonéales) par une chirurgie première radicale (hystérectomie totale sans conservation annexielle, omentectomie et résection sigmoïdienne) puis par une chimiothérapie à base de cisplatine et de 5FU (drogues habituellement utilisées dans les carcinomes épidermoïdes du col utérin et des cancers ORL) suivie d’une radiothérapie de 44 Gy sur le pelvis. Ils ont obtenu une survie sans récidive de 19 mois [16]. Pour Dos Santos et al. Les stades supérieurs à IC devraient être traités par une radiothérapie sur le pelvis avec chimiothérapie hebdomadaire concomitante à base de cisplatine. Ce traitement étant similaire à celui appliqué aux carcinomes épidermoïdes du col utérin et de la vulve. Deux patientes au stade IIB ont été traitées par ce protocole. La survie sans récidive était de 22 et 56 mois [4].
Le pronostic de cette affection est mauvais. Dans une série de 37 patientes, Kikkawa et al. [17] ont évalué la survie à cinq ans à 95% pour les stades I, 80% pour les stades II et0% pour les stades III et IV. Pour ces auteurs, le principal facteur pronostique paraît être le confinement de la tumeur au tissu ovarien et le respect de la capsule. La qualité de la résection chirurgicale est aussi un important facteur pronostique. Tseng et al. Ont rapporté une médiane de survie de 65 mois en cas de réduction tumorale complète versus 34,8 mois en cas de chirurgie incomplète [13]. D’autres éléments pronostiques sont identifiés notamment le stade clinique, le type histologique, le grade tumoral et l’invasion vasculaire.
La transformation maligne est une complication rare des kystes dermoïdes qui justifie l’exérèse de tout tératome ovarien même asymptomatique et ce quel que soit l’âge au moment du diagnostic. La dégénérescence est évoquée en préopératoire devant un faisceau d’arguments incluant la survenue en période péri-ménopausique, un taux de SCC supérieur ou égal à 2ng/ml, une taille supérieure à 99 mm dans son grand axe, une croissance rapide supérieure à 2 cm par an ainsi que des critères morphologiques révélés par les explorations radiologiques. L’intérêt de ces critères est d’éviter l’abord coelioscopique à l’origine de greffes péritonéales qui modifient le pronostic
- Wei F, Jiang Z, Yan C. Analysis of 20 mature ovarian cystic teratoma cases in postmenopausal women. Chin Med J (Engl). 2001;114:137-8 pubmed
- Driss M, Limaiem F, Mrad K, Charfi L, Abbes I, Sassi S, Hechiche M, Saadi A, Ben Romdhane K. Association synchrone d’un tératome de l’ovaire cancérisé associé à un tératome du médiastin .A propos d’un cas. Rev Med Interne 2009 ; 30 : 369-71.
- Argoitia X, Duga I, Labeyrie E, Toledo L, Couteau C, QuerleuD. Dégénérescence des kystes dermoïdes. A propos d’un cas de transformation maligne. Gynecol Obstet Fertil 2007 ; 35 : 1005-8.
- Bidnenko S, Parkhomenko L, Open'ko L. [Serotyping of Proteus using a rapid system]. Lab Delo. 1991;:58-61 pubmed
- Noumoff J, LiVolsi V, Deger R, Montone K, Faruqi S. Chromosome analysis and comparison of the benign cystic and malignant squamous component of an ovarian teratoma. Cancer Genet Cytogenet. 2001;125:59-62 pubmed
- Emoto M, Obama H, Horiuchi S, Miyakawa T, Kawarabayashi T. Transvaginal color Doppler ultrasonic characterization of benign and malignant ovarian cystic teratomas and comparison with serum squamous cell carcinoma antigen. Cancer. 2000;88:2298-304 pubmed
- Lai P, Hsieh S, Chien J, Fang C, Chan W, Yu C. Malignant transformation of an ovarian mature cystic teratoma: computed tomography findings. Arch Gynecol Obstet. 2005;271:355-7 pubmed
- Kido A, Togashi K, Konishi I, Kataoka M, Koyama T, Ueda H, et al. Dermoid cysts of the ovary with malignant transformation: MR appearance. AJR Am J Roentgenol. 1999;172:445-9 pubmed
- Yamanaka Y, Tateiwa Y, Miyamoto H, Umemoto Y, Takeuchi Y, Katayama K, et al. Preoperative diagnosis of malignant transformation in mature cystic teratoma of the ovary. Eur J Gynaecol Oncol. 2005;26:391-2 pubmed
- Tangjitgamol S, Manusirivithaya S, Sheanakul C, Leelahakorn S, Thawaramara T, Jesadapatarakul S. Squamous cell carcinoma arising from dermoid cyst: Case reports and review of literature. Int J Gynecol Cancer. 2003;13:558-63 pubmed
- Mori Y, Nishii H, Takabe K, Shinozaki H, Matsumoto N, Suzuki K, et al. Preoperative diagnosis of malignant transformation arising from mature cystic teratoma of the ovary. Gynecol Oncol. 2003;90:338-41 pubmed
- Suzuki M, Kobayashi H, Sekiguchi I, Konnai K, Terao T, Sato I. Clinical evaluation of squamous cell carcinoma antigen in squamous cell carcinoma arising in mature cystic teratoma of the ovary. Oncology. 1995;52:287-90 pubmed
- Tseng C, Chou H, Huang K, Chang T, Liang C, Lai C, et al. Squamous cell carcinoma arising in mature cystic teratoma of the ovary. Gynecol Oncol. 1996;63:364-70 pubmed
- Kikkawa F, Nawa A, Tamakoshi K, Ishikawa H, Kuzuya K, Suganuma N, et al. Diagnosis of squamous cell carcinoma arising from mature cystic teratoma of the ovary. Cancer. 1998;82:2249-55 pubmed
- Kornreich F, Holt J, Barnard A, Snoeck J, Kramer J, Kornreich J, et al. Comparison of Frank's and McFee's lead systems using multivariate statistics. Eur J Cardiol. 1976;4:131-40 pubmed
- Bukulmez O, Genc C, Karamursel B, Ayhan A. Mature cystic teratomas of the ovary: case series from one institution over 34 years. Eur J Obstet Gynecol Reprod Biol. 2000;88:153-7 pubmed
- Kikkawa F, Ishikawa H, Tamakoshi K, Nawa A, Suganuma N, Tomoda Y. Squamous cell carcinoma arising from mature cystic teratoma of the ovary: a clinicopathologic analysis. Obstet Gynecol. 1997;89:1017-22 pubmed