Les maladies cardiovasculaires sont la principale cause de décès chez les patients hémodialysés. Beaucoup d’études se sont intéressées aux troubles de rythme et aux blocs de branches mais les anomalies de la conduction auriculo-ventriculaire sont moins étudiées chez les patients hémodialysés. Nous avons mené une étude prospective chez 52 patients en hémodialyse chronique. Notre objectif est de dépister les anomalies de la conduction auriculo-ventriculaire présentes chez ces patients surtout au cours de la séance de dialyse et leur relation avec les variables cliniques et de laboratoire. Les mécanismes incriminés dans la genèse de ces troubles de conduction sont l’hyperkaliémie, les calcifications cardiaques intéressant la valve mitrale, l’anneau mitral ou encore les voies de conduction.
Cardiovascular disease is the major cause of death in hemodialysis patients. Many studies have focused on disorders of rhythm and bundle branch blocks but abnormalities of atrioventricular conduction are less studied in hemodialysis patients. We conducted a prospective study in 52 patients on chronic hemodialysis. Our objective is to detect abnormalities of atrioventricular conduction present in these patients especially during the dialysis session and their relationship with clinical and laboratory variables. The mechanisms implicated in the genesis of these conduction disturbances are hyperkalemia, cardiac calcifications involving the mitral valve, the mitral annulus or even conduction pathways.
Les maladies cardiovasculaires sont la principale cause de décès chez les patients hémodialysés. Les anomalies de la conduction auriculo-ventriculaire sont moins étudiées dans cette population. Ces anomalies risquent de mettre en jeu le pronostic vital. Même chez les patients avec un électrocardiogramme de repos normal. La détection à l'enregistrement Holter rythmique d'un bloc auriculo-ventriculaire d'un certains degré, voir d'un bloc auriculo-ventriculaire complet peut conduire à l'implantation d'un stimulateur cardiaque, aménager le traitement de ces patients et éviter un certains nombre de mort inexpliquée dans cette population [1] [2].
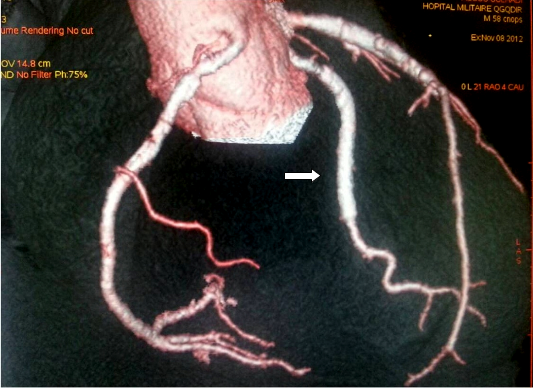
Nous avons mené une étude prospective chez 52 patients en hémodialyse chronique (3 x 4 heures/semaine). Notre objectif était de dépister les anomalies de la conduction auriculo-ventriculaire présentes chez ces patients surtout au cours de la séance de dialyse et leur relation avec les variables cliniques et de laboratoire. Les patients ont été soumis, après consentement, à un électrocardiogramme à 12 dérivations et un enregistrement Holter ECG de 24 heures. Les données cliniques ont été examinées afin d'évaluer la présence de comorbidités, ainsi que des mesures anthropométriques et la pression artérielle. Des échantillons de sang ont été prélevés pour déterminer les taux de : potassium, hémoglobine, ferritine, acide urique, calcium, phosphore, parathormone, vitamine D, albumine, phosphatases alcalines, C- réactive protéine, cholestérol total, LDL-cholestérol, HDL-cholestérol et triglycérides. Les patients atteints de bloc auriculo-ventriculaire symptomatique (BAV) ont subi une échocardiographie et ont fait l’objet de l’implantation de pacemaker. Un scanner cardiaque multicoupes (64 barrettes) a ensuite été réalisé pour évaluer la présence, la localisation des calcifications cardiaques, et déterminer le score calcique coronaire d’Agatston de chaque patient (figure 1). Le tampon de dialysat à base de bicarbonate contenait 3 mmol / l de potassium et 1,5 mmol / l de calcium.
| Cas n° 1 | Cas n° 2 | Cas n° 3 | Cas n° 4 | |
|---|---|---|---|---|
| Age | 69 | 56 | 62 | 60 |
| Taille | 165 | 172 | 180 | 179 |
| IMC | 18 | 26.4 | 21.4 | 22 |
| Ancienneté de dialyse | 126 | 39 | 171 | 7 |
| Cardiopathie ischémique | 1 | 0 | 0 | 1 |
| Diabète | 0 | 1 | 1 | 1 |
| Hypertension artérielle | 0 | 0 | 0 | 1 |
| Tabac | 0 | 0 | 0 | 1 |
| Dyslipidémie | 0 | 1 | 0 | 0 |
| Kalièmie (mmol/L) | 7.5 | 7.3 | 6.9 | 7.1 |
| Hémoglobine (g/dL) | 9.4 | 8.4 | 11.8 | 9.6 |
| Ferritine (ng/mL) | 242 | 534 | 112 | 215 |
| Acide urique (mg/L) | 31 | 77 | 52 | 38 |
| Calcémie (mmol/L) | 89 | 79 | 89 | 94 |
| Phosphorémie (mmol/L) | 16 | 48 | 40 | 81 |
| Parathormone (pg/mL) | 20 | 614 | 781 | 210 |
| Vitamine D (ng/mL) | 18 | 20 | 36.5 | 28 |
| Albumine (g/L) | 32 | 52 | 39.5 | 38 |
| Phosphatases alcalines (UI/L) | 700 | 87 | 190 | 124 |
| C- Réactive Protéine (mg/L) | 30.2 | 5.6 | 2 | 1.1 |
| Cholesterol (g/L) | 1 | 1.9 | 1.5 | 1.2 |
| LDL-Cholesterol (g/L) | 0.5 | 0.2 | 1 | 1.1 |
| HDL-Cholesterol (g/L) | 0.4 | 0.2 | 0.4 | 0.3 |
| Triglycerides (g/L) | 0.3 | 7.6 | 0.9 | 1.4 |
Le BAV complet a été découvert chez 4 patients (7,7%). Tous ces patients étaient des hommes. L’âge moyen était de 61 ans. La durée moyenne d'hémodialyse était de 83,25 mois. Des antécédents de cardiopathie ischémique sont notés chez deux patients. Trois patients étaient diabétiques et un patient était hypertendu (tableau 1). Les symptômes cliniques étaient essentiellement la fatigue et les malaises lipotymiques. Un cas de syncope avait nécessité l’arrêt de la séance de dialyse, une réanimation cardio-respiratoire et la montée sans délai d’une sonde d’entrainement électrosystolique. L’électrocardiogramme avait objectivé un bloc auriculo-ventriculaire complet chez le patient ayant présenté la syncope, mais aucun trouble de la conduction n’a été noté chez les autres patients. L’enregistrement Holter-ECG avait objectivé un BAV complet permanent chez le patient qui avait présenté la syncope, un BAV de haut degré paroxystique dans un cas et un BAV complet paroxystique dans deux cas. Deux patients avaient des calcifications des deux valves mitrale et aortique et un patient avait des calcifications seulement de la valve mitrale. L’hypertrophie ventriculaire gauche a été retrouvée dans deux cas. La dilatation de l’oreillette gauche a été retrouvée dans un cas. La fonction systolique ventriculaire gauche était normale dans trois cas. Le scanner cardiaque mulicoupes avait mis en évidence un haut score d’Agatston (> 401) dans trois cas. L'artère interventriculaire antérieure était l’artère coronaire la plus touchée par les calcifications (tableau 2). On n’avait pas noté, à court ou à moyen terme, de complications liées à l'implantation des pacemakers.
| ECG | Holter ECG | Echocardiographie | Scanner cardiaque multicoupes (64 barrettes) | |||
|---|---|---|---|---|---|---|
| Artère atteinte | Agatston Score | Gamme percentile | ||||
| Cas n°1 | BAV Complet | BAV Complet permanent | CV mitrale et aortique EF= 25% | IVA, Cx, CD, Diag | 1191 | 90 |
| Cas n°2 | Pas de trouble de conduction AV | BAV de haut degré paroxystique | CV mitrale et aortique EF= 64% | IVA, Cx, CD, Diag | 857 | 80 |
| Cas n°3 | Pas de trouble de conduction AV | BAV Complet paroxystique | EF= 65% | IVA | 9 | 40 |
| Cas n°4 | Pas de trouble de conduction AV | BAV Complet paroxystique | CV aortique EF= 58% | IVA, Cx, CD, Diag | 453 | 80 |
Chez les patients hémodialysés chroniques, on peut pratiquement rencontrer tous les troubles de rythme, supraventriculaires ou ventriculaires: les tachycardies sinusales, l’arythmie complète par fibrillation auriculaire, les extrasystoles supraventriculaires ou ventriculaires, les tachycardies ventriculaires voire les fibrillations ventriculaires, et tous les troubles de la conduction: les troubles de la fonction sinusale et les troubles de la conduction auriculo-ventriculaire et intraventriculaire.
Concernant les troubles de la conduction, plusieurs mécanismes sont incriminés à savoir l’hyperkaliémie, les calcifications cardiaques intéressant la valve mitrale, l’anneau mitral ou encore les voies de conduction.
En 1911 Mathison [3] a observé chez certains chats décérébrés et vagotomisés que le potassium produit un ralentissement progressif de la fréquence cardiaque, mais dans d'autres cas, un ralentissement brutal du rythme cardiaque en raison de la dissociation auriculo-ventriculaire, provoquant ainsi un bloc auriculo-ventriculaire (BAV) 2/1, voire un BAV complet. Cette observation que le potassium est capable de provoquer un BAV de haut degré a été confirmée par un certain nombre d'études ultérieures [4] [5] [6].
Les anomalies électrocardiographiques qui peuvent survenir chez les patients atteints d'hyperkaliémie comprennent le raccourcissement de l'intervalle QT, des ondes T amples, positives, symétriques et pointues, à base étroite, un élargissement des QRS > 0,12 sec (conduction intraventriculaire), une déviation axiale gauche fréquente, un élargissement et diminution de l’amplitude puis disparition de l’onde P, un pseudo sus décalage du segment ST, des arythmies supraventriculaires et ventriculaires y compris la tachycardie et la fibrillation ventriculaires, un bloc auriculo-ventriculaire et l’asystolie [6] [7] [8].
La plupart des cas rapportés concernent les blocs de branche [9] [10] [11] [12] [13] [14] [15]. Le bloc de branche traduisant un retard dans l'activation de l'un des ventricules a été attribué à un effet électrophysiologique direct [6] [16] ou à une ischémie sous-endocardique induite par l'hyperkaliémie [7] [8]. Bashour et al [11] ont rapporté que les études électrophysiologiques utilisant l’enregistrement de faisceau de His et la stimulation auriculaire ont révélé un retard de la conduction intra-auriculaire et un allongement du temps de conduction dans le système His-Purkinje.
Le BAV a été démontré expérimentalement chez l'animal. Le potassium, selon le niveau plasmatique et le débit de perfusion a démontré un effet quantitativement différent, et parfois opposé, sur la conduction AV, la conduction intraventriculaire, l'automaticité et sur l'excitabilité [6]. Le BAV du deuxième ou du troisième degré provoqué par l’hyperkaliémie, a été rarement documenté chez l'homme [6] [11].
Le développement de BAV, de deuxième et de troisième degré, est généralement constaté chez les patients présentant une insuffisance cardiaque préexistante, une anomalie de la conduction, ou autre maladie cardiaque [17]. Une maladie cardiaque préexistante peut potentialiser le blocage la conduction cardiaque par l’hyperkaliémie, en particulier en cas de BAV de deuxième ou troisième degré [11] [17] [18]. La maladie coronarienne sous-jacente aurait déjà endommagé la voie de conduction à travers le nœud AV et le système His-Purkinje, et qu'une hyperkaliémie aurait aggravée cette anomalie de conduction préexistante [19].
Deux patients de notre série avaient une cardiopathie ischémique préexistante. Le premier patient avait un BAV complet découvert à l’occasion de syncope mais le deuxième patient n’avait pas de trouble de conduction préexistant. On peut trouver probablement une réponse dans cette explication fournie par Sohoni [19]. Mais nos deux patients présentent également un score d’Agatston élevé. Seulement le premier patient avait aussi des calcifications de la valve mitrale.
Les calcifications cardiaques sont devenues un sujet tout à fait banal chez le malade dont l’insuffisance rénale chronique est arrivée au stade terminal (IRCT). Les deux formes de calcifications, dystrophiques et métastatiques, sont très souvent étroitement associées [20]. Les localisations évoluées incluent le cœur, les valves, le système de conduction et les artères coronaires. Le problème épineux est la détection précoce et la quantification des dépôts de calcium. Le développement récent de techniques d’imagerie plus sensibles comme la fluoroscopie digitale [21] et la tomographie par émission de positons [22] [23] permettra de déterminer avec plus de précision la présence et la progression des calcifications myocardiques, valvulaires, coronariennes, artérielles et vasculaires périphériques. Cependant, ces techniques ne sont pas encore disponibles en routine clinique. L’écho-Doppler cardiaque en pratique de routine garde toujours une place dans le dépistage des calcifications valvulaires dont la fréquence et la prévalence sont croissantes en fonction de la durée de la dialyse [24]. Le scanner cardiaque ultrarapide, dans les centres qui en disposent, est un excellent outil pour détecter et quantifier le calcium dans les artères coronaires. Il est plus sensible que la fluoroscopie. Le score d’Agatston est un excellent moyen pour quantifier le calcium au niveau des artères coronaires. La valeur prédictive négative d'un score à 0 était de 98%, 94% et 100% pour les groupes d'âge de 40 à 49, de 50 à 59 et 60 à 69 ans, respectivement [25].
Les calcifications du système de conduction, en particulier du nœud auriculoventriculaire et du faisceau de His, ont été décrites [26] [27], en association avec des troubles de la conduction auriculo-ventriculaire dont le BAV complet et la mort subite.
Les valves mitrales et aortiques sont un site majeur des calcifications cardiaques chez les patients en IRCT [22] [26] [28] [29]. Les calcifications de la valve mitrale ont été rapportées chez plus de 47% des patients hémodialysés et sont associées à un risque accru de mortalité par rapport aux patients qui n'ont pas de calcifications valvulaires [30] [31]. Les calcifications de l’anneau mitral dans l’insuffisance rénale ont une grande signification clinique, du fait de leur association à une fréquence plus élevée de trouble de rythme et de la conduction cardiaque [28] [32] [33]. Les patients avec calcifications de la valve mitrale ou de l’anneau mitral ont particulièrement montré une prévalence plus élevée du BAV de premier degré et des blocs de branche [34].
La prévalence des dépôts phosphocalciques myocardiques est très variable d’une étude à l’autre. Les facteurs généraux et systémiques potentiellement impliqués dans les calcifications cardiaques dans l’insuffisance rénale chronique sont l’hyperphosphorémie, l’augmentation du produit Ca × P, l’âge, la durée du traitement par dialyse, l’origine ethnique, le diabète sucré, l’hypertension artérielle, l’hyperparathyroïdie, l’hypoparathyroïdie associée à l’ostéopathie adynamique (avec ou sans intoxication aluminique), l’excès ou le déficit en vitamine D, l’excès ou le déficit en vitamine K, l’acidose métabolique (dialyse à l’acétate), l’excès de magnésium, la surcharge en fer, l’altérations du système de coagulation et le traitement par héparine ou warfarine. Les facteurs locaux potentiellement impliqués dans les calcifications cardiaques dans l’insuffisance rénale chronique sont les lésions tissulaires focales (hématome, infection, injection d’héparine), les modifications locales du pH, les modifications locales des protéines protectrices ou inductrices, le développement de novo de cellules « osteoblast-like » calcifiantes et la surexpression locale de facteurs de croissance [35].
Dans leur étude sur la prévalence et les facteurs de risque de calcifications valvulaires cardiaques dans une cohorte de 129 patients hémodialysés chroniques, Sayarlioglu et ses collègues [36] ont noté une corrélation entre les calcifications valvulaires d’une part et l’âge des patients, l’ancienneté de la dialyse, le diabète sucré et le faible taux d’albumine d’autre part. Les auteurs n'ont pas pu démontrer de corrélation entre les calcifications valvulaires et les taux de cholestérol total, lipoprotéines de basse densité cholestérol, lipoprotéines de haute densité cholestérol, triglycérides, calcium, phosphore, produit de calcium et de phosphore, ou parathormone. On retrouve les mêmes corrélations dans notre série.
Les anomalies de la conduction auriculo-ventriculaire sont sévères et souvent masquées chez le dialysé. La gravité de ces pathologies justifie largement la réalisation d’explorations non invasives systématiques chez ces patients. L’électrocardiogramme de repos est un examen peu spécifique chez ces patients présentant très fréquemment des troubles de la repolarisation en rapport avec l’hypertrophie ventriculaire gauche. L’enregistrement Holter ECG de 24 heures est un examen non invasif, peu couteux, qui permet la détection de ces troubles de conduction et expliquer en grande partie les symptômes ressentis par les patients au cours des séances de dialyse. Dans ce contexte, l’échocardiographie transthoracique permet de détecter les calcifications valvulaires. Le score d’Agatston est un excellent indicateur de risque de coronaropathie chez cette population chez qui les maladies cardiovasculaires sont la principale cause de mortalité.
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Je tiens à remercier très sincèrement mon fils Amir RBAIBI pour son assistance continue durant l'élaboration de cet article.
- Mandić A, Tomic M, Petrov B, Romic Z. Atrial fibrillation, atrioventricular blocks and bundle branch blocks in hemodialysis patients. Coll Antropol. 2012;36:1395-9 pubmed
- Bignotto L, Kallás M, Djouki R, Sassaki M, Voss G, Soto C, et al. Electrocardiographic findings in chronic hemodialysis patients. J Bras Nefrol. 2012;34:235-42 pubmed
- Mathison G. The effects of potassium salts upon the circulation and their action on plain muscle. J Physiol. 1911;42:471-94 pubmed
- Mclean FC, Bay EB, Hasting AB: Electrical changes in the isolated heart of the rabbit following changes in the potassium content of the perfusing fluid. Am J Physiol. 1933, 105: 72.
- Fisch C, Feigenbaum H, Bowers J. The effect of potassium on atrioventricular conduction of normal dogs. Am J Cardiol. 1963;11:487-92 pubmed
- Fisch C, Knoebel S, Feigenbaum H, Greenspan K. Potassium and the monophasic action potential, electrocardiogram, conduction and arrhythmias. Prog Cardiovasc Dis. 1966;8:387-418 pubmed
- Levine H, Merrill J, Somerville W. Advanced disturbances of the cardiac mechanism in potassium intoxication in man. Circulation. 1951;3:889-905 pubmed
- Ohmae M, Rabkin S. Hyperkalemia-induced bundle branch block and complete heart block. Clin Cardiol. 1981;4:43-6 pubmed
- Katsikas J, Goldsmith C. Disorders of potassium metabolism. Med Clin North Am. 1971;55:503-12 pubmed
- Punja M, Schneebaum R, Cohen J. Bifascicular block induced by hyperkalemia. J Electrocardiol. 1973;6:71-6 pubmed
- Bashour T, Hsu I, Gorfinkel H, Wickramesekaran R, Rios J. Atrioventricular and intraventricular conduction in hyperkalemia. Am J Cardiol. 1975;35:199-203 pubmed
- O'Neil J, Chung E. Unusual electrocardiographic finding--bifascicular block due to hyperkalemia. Am J Med. 1976;61:537-40 pubmed
- Lichstein E, Gupta P, Grunwald A. Hyperkalemic fascicular block. Chest. 1976;70:290-1 pubmed
- Weidner N, Gaum W, Chou T, Kaplan S. Hyperkalemia-electrocardiographic abnormalities. J Pediatr. 1978;93:462-4 pubmed
- Shapiro J. Bifascicular block produced by hyperkalemia. Cardiology. 1979;64:303-5 pubmed
- Weidmann S. Shortening of the cardiac action potential due to a brief injection of KCl following the onset of activity. J Physiol. 1956;132:157-63 pubmed
- Cohen H, Rosen K, Pick A. Disorders of impulse conduction and impulse formation caused by hyperkalemia in man. Am Heart J. 1975;89:501-9 pubmed
- El-Sherif N, Scherlag B, Lazzara R. Second-degree atrioventricular block in the His-Purkinje system following acute myocardial infarction. Clinical observations on its evolution. Chest. 1977;71:615-23 pubmed
- Sohoni A, Perez B, Singh A. Wenckebach Block due to Hyperkalemia: A Case Report. Emerg Med Int. 2010;2010:879751 pubmed
- Parfitt A. Soft-tissue calcification in uremia. Arch Intern Med. 1969;124:544-56 pubmed
- Alexopoulos D, Toulgaridis T, Sitafidis G, Christodoulou J, Foussas S, Hahalis G, et al. Coronary artery calcium detected by digital fluoroscopy and risk factors in healthy subjects. Am J Cardiol. 1996;78:474-6 pubmed
- Braun J, Oldendorf M, Moshage W, Heidler R, Zeitler E, Luft F. Electron beam computed tomography in the evaluation of cardiac calcification in chronic dialysis patients. Am J Kidney Dis. 1996;27:394-401 pubmed
- Callister T, Raggi P, Cooil B, Lippolis N, Russo D. Effect of HMG-CoA reductase inhibitors on coronary artery disease as assessed by electron-beam computed tomography. N Engl J Med. 1998;339:1972-8 pubmed
- Beygui F, Dumaine R, Payot L, Collet JP, Choussat R, Montalescot G. Explorations cardiaques chez l’hémodialysé et le transplanté rénal. mt cardio 2005,1: 541-6.
- Agatston A, Janowitz W, Hildner F, Zusmer N, Viamonte M, Detrano R. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 1990;15:827-32 pubmed
- Abe K, Taguchi K, Wasai T, Ren J, Utsunomiya I, Shinohara T, et al. Biochemical and pathological study of endogenous 1-benzyl-1,2,3,4-tetrahydroisoquinoline-induced parkinsonism in the mouse. Brain Res. 2001;907:134-8 pubmed
- Henderson R, Santiago L, Spring D, Harrington A. Metastatic myocardial calcification in chronic renal failure presenting as atrioventricular block. N Engl J Med. 1971;284:1252-3 pubmed
- Benjamin E, Plehn J, D'Agostino R, Belanger A, Comai K, Fuller D, et al. Mitral annular calcification and the risk of stroke in an elderly cohort. N Engl J Med. 1992;327:374-9 pubmed
- Fernandez-Reyes M, Auxiliadora Bajo M, Robles P, Selgas R, Oliver J, Del Peso G, et al. Mitral annular calcification in CAPD patients with a low degree of hyperparathyroidism. An analysis of other possible risk factors. Nephrol Dial Transplant. 1995;10:2090-5 pubmed
- Sharma R, Pellerin D, Gaze D, Mehta R, Gregson H, Streather C, et al. Mitral annular calcification predicts mortality and coronary artery disease in end stage renal disease. Atherosclerosis. 2007;191:348-54 pubmed
- Wang A, Wang M, Woo J, Lam C, Li P, Lui S, et al. Cardiac valve calcification as an important predictor for all-cause mortality and cardiovascular mortality in long-term peritoneal dialysis patients: a prospective study. J Am Soc Nephrol. 2003;14:159-68 pubmed
- Mazzaferro S, Coen G, Bandini S, Borgatti P, Ciaccheri M, Diacinti D, et al. Role of ageing, chronic renal failure and dialysis in the calcification of mitral annulus. Nephrol Dial Transplant. 1993;8:335-40 pubmed
- Lin C, Schwartz I, Chapman I. Calcification of the mitral annulus fibrosus with systemic embolization. A clinicopathologic study of 16 cases. Arch Pathol Lab Med. 1987;111:411-4 pubmed
- Shurmur S, D'Elia J, Gleason R, Nesto R, DeSilva R, Weinrauch L. Cardiac conduction defects associated with aortic and mitral valve calcification in dialysis patients. Ren Fail. 1990;12:103-7 pubmed
- Drüeke TB, Touam M, Thornley-Brown D, Rostand SG. Calcifications extra-osseuses chez le patient insuffisant rénal chronique. Actualités néphrologiques Jean Hamburger 2000.
- Sayarlioglu H, Acar G, Sahin M, Altunoren O, Coskun Yavuz Y, Nacar A, et al. Prevalence and risk factors of valvular calcification in hemodialysis patients. Iran J Kidney Dis. 2013;7:129-34 pubmed
